7月30日,我校国家卫生健康委配子及生殖道异常研究重点实验室曹云霞/梁丹教授团队,联合中科院动物所郭帆教授团队在《自然(Nature)》权威子刊《自然-细胞生物学 (Nature Cell Biology)》(IF=17.3), 发表题为《人类早期胚胎发育过程中亲本基因组DNA羟甲基化全基因组分布及分子调控(Distinct dynamics of parental 5-hydroxymethylcytosine during human preimplantation development regulate early lineage gene expression)》的研究论文。我校梁丹教授、第一附属医院纪冬梅副教授为本文共同第一作者,曹云霞、梁丹、郭帆和上海交通大学医学院附属第一人民医院贺小进教授为该研究论文的共同通讯作者,我校第一附属医院为第一作者单位。
DNA甲基化(5-甲基胞嘧啶,5mC)是哺乳动物中一种重要的表观遗传修饰,对人类早期胚胎发育至关重要。在哺乳动物的个体发育过程中,会经历两次全基因组范围的DNA甲基化重编程,分别发生在从受精到着床的早期胚胎发育阶段,以及配子发生过程中。这些重编程过程均涉及到基因组范围内的主动去甲基化反应。其中,TET双加氧酶家族蛋白能够连续氧化5mC,从而介导DNA的主动去甲基化过程。作为这一去甲基化过程中重要的中间产物,5-羟甲基胞嘧啶(5hmC)被认为是调控DNA甲基化状态的关键分子。尽管5hmC在所有5mC中仅占很小的一部分,但其在体细胞中的含量依然显著高于其他中间产物,这暗示它可能还具有其他未知的生物学功能。已有研究揭示了小鼠早期胚胎发育全过程中的5hmC动态及其分子调控。然而,目前尚未有关于人类早期胚胎中5hmC动态与功能的研究报道,限制了我们对人类胚胎发育起始阶段表观遗传机制的认识。
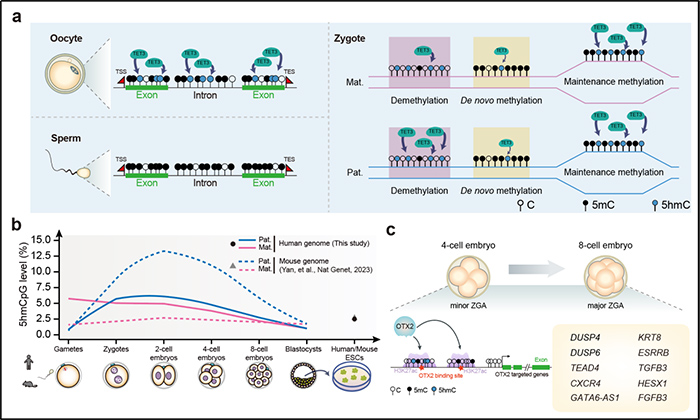
该研究利用前沿的微量细胞5hmC全基因组解析方法,对人早期胚胎中5hmC的功能作用及其生物学意义进行了系统解析。研究发现,人卵细胞在生长过程中经历了从头DNA羟甲基化,显著累积了5hmC。在受精后,母本基因组中的5hmC得以继承,而父本基因组则部分“参照”母本基因组产生,这一机制与小鼠早期胚胎中5hmC的不对称性分布存在显著差异。这一发现不仅揭示了人类和小鼠之间在早期胚胎发育中表观遗传机制的不同,也为深入理解人类独特的发育过程提供了新视角。此外,研究还指出,5hmC不仅参与DNA甲基化擦除事件,还与维持性DNA甲基化区域密切相关。部分5hmC修饰能够持续到八细胞时期,并富集于关键转录因子结合位点,如OTX2、TFAP2C和KLF4/5,并进一步证明了5hmC与增强子及OTX2之间的互作关系参与人早期胚胎发育的调控作用。
研究为我们揭示5hmC在人类早期胚胎发育中的独特动态和多重功能奠定了基础,也有助于深入理解多能性建立、细胞谱系分化以及转录-表观调控之间复杂关系的重要性,对增强人类早期胚胎发育表观遗传调控机制的认识以及促进临床上早期胚胎发育异常阻滞的诊治具有重要的意义。
该研究工作得到了国家自然科学基金委、科技部、安徽省转化医学研究院科研基金等提供的多项项目资助。(安徽医科大学国家卫生健康委配子及生殖道异常研究重点实验室)
论文链接:https://www.nature.com/articles/s41556-024-01475-y

